СТАТЬИ
ГИПОХОРИТ НАТРИЯ. ПРОЦЕСС ПОЛУЧЕНИЯ
(автор: Ген.директор компании "МИРОВЫЕ ВОДНЫЕ ТЕХНОЛОГИИ" - С.В.Черкасов)
1. Общие сведения
2. Производство ГПХН с мембранным разделением электродного пространства
3. Производство ГПХН без мембранного разделения электродного пространства
4. Влияние межэлектродного расстояния на процесс получения ГПХН
5. Непроточные установки получения ГПХН
1. Общие сведения
Производство гипохлорита натрия (ГПХН) осуществляют методом электролиза раствора хлористого натрия NaCl (поваренной соли). При этом используют два пути получения конечного продукта: с применением мембранного разделения катодного и анодного (электродного) пространства электролизера и без такого разделения. В зависимости от этого процесс получения ГПХН происходит по различным схемам:
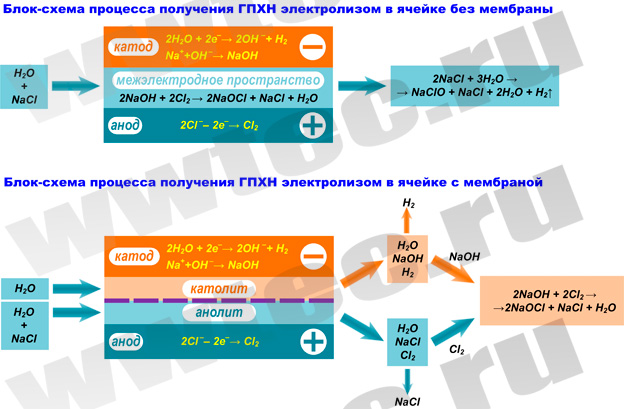
2. Производство ГПХН с мембранным разделением электродного пространства
В мембранной электролизной установке анодное и катодное пространство отделяются друг от друга катион-проницаемой мембраной. При этом в анодную камеру подается раствор поваренной соли, а в катодную камеру – вода.
На катоде вода (H2O) под воздействием электрического тока разлагается на ионы гидроксила (OH–) и водород (H2):
2Н2О + 2е– → 2ОН– + Н2
На аноде - хлориды (Cl–) окисляются до молекулярного хлора (Cl2):
2Cl–→ Cl2 + 2e–↑
Под воздействием электрического тока катионы натрия (Na+) диффундируют через мембрану, переходят в катодное пространство (католит) и взаимодействуют с анионами OH–, образуя при этом едкий натрий (NaOH):
Технологическая схема процесса производства ГПХН с использованием диафрагменного электролизера приведена на следующем рисунке:
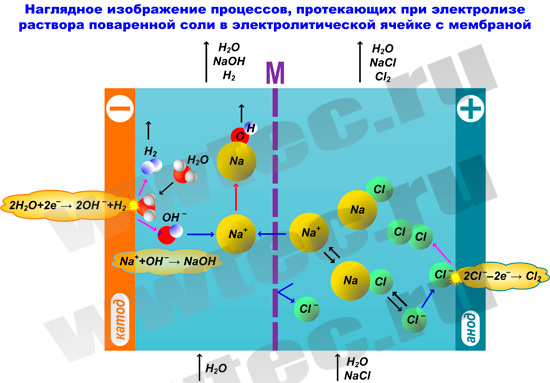
Из электролизера анолит, содержащий молекулярный хлор и часть поваренной соли, которая не разложилась на аноде, направляется в сепаратор для отделения из него хлора. После отделения хлора в сепараторе происходит измерение плотности анолита и при помощи насоса-дозатора добавляется необходимое количество насыщенного раствора поваренной соли.
Выделенный из анолита хлор подается в реактор, где он вступает в реакцию с католитом, который содержит едкий натрий и водород, образуя ГПХН, который собирают в приемную емкость. Водород из реактора сбрасывается на «свечу» или в атмосферу при многократном разбавлении его воздухом. Для снижения энергозатрат в схеме устанавливают два рекуперационых теплообменника.
3. Производство ГПХН без мембранного разделения электродного пространства
Производство ГПХН прямым электролизом раствора поваренной соли (без мембранного разделения электродного пространства) является более простым и более распространенным методом. В этом случае электролизер выполняется в виде некоторой емкости (реактора), в которой размещаются электроды (катод и анод).
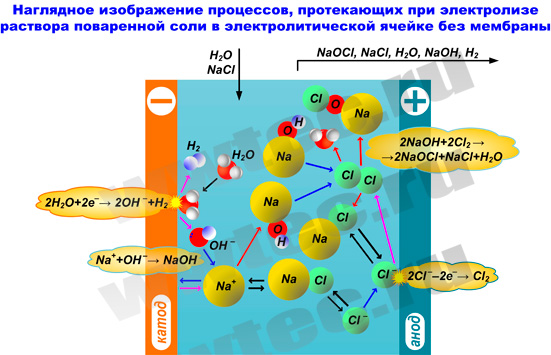
При прямом электролизе раствора хлорида натрия происходят следующие реакции:
на катоде:
2Na+ + 2e– → 2Na;
2Na + 2H2O → 2NaOH + H2↑;
на аноде:
2Cl– - 2e– → Cl2;
Cl2 + H2O → HClO + HCl.
Получающийся в результате реакции гидрооксид натрия взаимодействует с хлорной и хлорноватистой кислотами, образуя соответственно хлорид и гипохлорит натрия. Суммарную реакцию можно записать следующим образом:
2NaCl + 3H2O → NaClO + NaCl + 2H2O + H2↑
Основным показателем процесса электролиза является выход по току целевого продукта (ГПХН), выражаемый в %,
h = (G / Gт)· 100, %
где G и Gm – количество продукта, кг, фактически и теоретически получаемого при электролизе.
Количество продукта Gт, кг, которое теоретически должно выделиться на аноде при электролизе, может быть определено по закону Фарадея:
Gт = A· I· n· t / 1000,
где, А – электрохимический эквивалент, г/(А·ч)
I – полный ток через электролизер, А
n – число работающих анодов
t – продолжительность работы электролизера, час
Таким образом, теоритически из 1,64 кг соли (NaCl) можно получить 1 кг гипохлорита натрия (NaClO). Однако помимо основной электрохимической реакции и на катоде, и на аноде протекают побочные реакции и вторичные процессы, снижающие выход по току ГПХН:
- электрохимическое окисление гипохлорита до хлората ClO3–:
6ClO– – 6е– → ClO3– + 1,5О2 + 5Cl–;
- химическая реакция разложения аниона гипохлорита:
2ClO– → О2 + 2Cl–,
которая особенно активируема в присутствии загрязнений электролита железом, медью, никелем.
- восстановление гипохлорита и хлората на катоде:
ClO– + Н2O + 2е– → Cl– + 2ОH–.
Величина выхода по току (h ) является основным показателем любого процесса электролиза. Чем выше его значение, тем эффективнее протекает процесс электролиза, тем ниже энергетические затраты на получение единицы готового продукта. При высоких значениях h можно уменьшить требуемую площадь рабочей поверхности электродов для достижения заданной производительности, применить более компактные установки и снизить расходы на их изготовление. И хотя целевым продуктом процесса электролиза в нашем случае является ГПХН основным показателем процесса надо считать выход по току хлора.
На изменение выхода по току h влияет ряд факторов:
- величина напряжения на электролизере
Величина выхода хлора по току ГПХН сказывается в первую очередь на изменении затрат электроэнергии W, кВт-ч/кг, при получении гипохлорита натрия, которые могут быть подсчитаны по формуле:
W = I· U· t / G или W = U / A·h· n
где U – напряжение на токоподводящих электродах, В.
Выход по току гипохлорита увеличивается с возрастанием анодной плотности тока, так как в этих условиях затрудняется доступ ионов СlO– к аноду. При очень малых плотностях тока, отвечающих интервалу потенциалов +0,8 – 1,33 В, на аноде будет выделяться кислород, затем при достижении равновесного потенциала выделения хлора начнется совместное выделение кислорода и хлора, причем с ростом плотности тока выход по току хлора будет быстро возрастать. При плотностях тока около 1000 А/м2 на выделение кислорода будет расходоваться всего несколько процентов тока.


Повышая напряжение на токоподводящих электродах, мы увеличиваем силу тока. Таким образом, при сохранении максимально возможного значения выхода по току хлора можно увеличить (в определенных пределах) производительность установки без существенного отклонения энергетических затрат от минимальных.
- исходная концентрация электролита
Чем выше концентрация хлоридов, тем меньше перенапряжение выделения хлора, т.к. его равновесный потенциал сильнее сдвигается в электроотрицательную сторону. Следовательно, увеличение концентрации NaCl облегчает выделение хлора. С другой стороны, чем выше концентрация раствора NaCl, тем больше удельный расход поваренной соли на 1 кг гипохлорита натрия. Поэтому для практического использования концентрацию исходного раствора хлористого натрия выбирают в зависимости от требуемой концентрации гипохлорита натрия.

- степень использования раствора хлоридов
Технико-экономические показатели работы электролизера определяются не только затратами электроэнергии, но и достигаемой степенью использования исходного раствора поваренной соли, поскольку затраты на соль являются одной из главных статей расхода при производстве гипохлорита натрия.
Под степенью использования соли (процентом разложения) λ, %, понимают отношение концентрации активного хлора в растворе гипохлорита натрия, полученного в результате электролиза, к концентрации NaCl, вводимой в установку:
λ = (ССlакт / CNaCl) · 100,
где ССlакт – концентрация активного хлора в гипохлорите натрия, CNaCl – концентрация NaCl в электролите, г/л.
По мере увеличения концентрации активного хлора и растворе расход соли на получение единицы готового продукта снижается. Так, при электролизе раствора с концентрацией 100 г/л NaCl и достижении содержания активного хлора на выходе из электролизера 5 г/л расход соли составляет 20 г на 1 г готового продукта (5% – ое разложение). При содержании же хлора в растворе 10 г/л затраты на соль уменьшаются и составляют всего 10 г/л (10% – ое разложение).
Таким образом, для снижения расходов на соль предпочтительно ведение процесса электролиза при глубоком разложении NaCl. Однако увеличение степени использования поваренной соли приводит к росту энергетических затрат, поэтому должен быть найден какой-то оптимальный режим эксплуатации установки, при котором суммарные затраты на соль и электроэнергию будут минимальны.
- образование отложений на катодах
Еще одним фактором, влияющим на процесс электролиза раствора хлорида натрия и снижения выхода по току гипохлорита натрия, является образование на катодах отложений (чаще всего отложений солей жесткости).Рядом исследователей было установлено, что скорость образования осадков и их структура зависят от:
- плотности тока и времени поляризации – с увеличением плотности тока и времени поляризации обрастание катода происходит интенсивнее;
- химического состава раствора – с увеличением жесткости исходной воды и применении в качестве исходного сырья неочищенной (технической) поваренной соли скорость образования катодных отложений возрастает;
- состояния поверхности электродов – скорость «налипания» отложений снижается при применении электродов с более гладкой поверхностью. Наилучшие результаты достигаются при использовании полированных катодов.
Механизм образования отложений, по всей вероятности, следующий: в прикатодном пространстве первичным продуктом электрохимического процесса является щелочь, образующаяся в результате разложения воды. При наличии в растворе катионов Са2+ и Mg2+ происходит образование соответствующих гидроокисей, а в присутствии анионов СО32– карбонатов. Первоначально на катоде появляются тонкая пленка и отдельные кристаллы, количество которых со временем увеличивается, и вся поверхность катода постепенно покрывается осадком. Толщина осадка непрерывно возрастает, и, в конце концов, межэлектродное пространство забивается отложениями, снижается сила тока, проходящего через электролизер, и уменьшается производительность установки.
Существует несколько технических приемов, применение которых предотвращает рост осадков на катодах:
- создание высокой линейной скорости движения жидкости относительно электродов;
- механическая очистка поверхности катодов;
- периодическая кислотная обработка поверхности катодов;
- «скалывание» осадков с катодов путем кратковременного изменения полярности электродов.
- характер движения электролита
Весьма существенное значение имеет характер движения электролита. Если прианодный слой электролита не нарушается, то в нем находится преимущественно слабо диссоциированная хлорноватистая кислота, а образование гипохлорита натрия происходит на некотором расстоянии от анода. В этом случае ионы СlO– могут поступать к аноду из глубины раствора только благодаря диффузии и электропереносу, поэтому при отсутствии перемешивания прианодного слоя в растворе может накапливаться гипохлорит натрия более высокой концентрации, чем это соответствует началу разряда ионов СlO–. Из всего перечисленного следует, что необходимо избегать механического перемешивания раствора.
- материал анодов
Если в качестве катодного материала могут использоваться обычная сталь, графит, титан, то к анодам предъявляются особые требования.
Во-первых, аноды работают в условиях непосредственного контакта с химически активными веществами, поэтому основным требованием к материалу анода является их химическая устойчивость.
Во-вторых, для проведения процесса электролитического получения ГПХН с минимальными энергетическими затратами большое значение имеет материал анода. Материал анода должен способствовать разряду ионов Сl–, т.е. перенапряжение выделения хлора на нем должно быть наименьшим.
До 70-х годов предыдущего века для электролитического производства ГПХН наиболее широко применяли графитовые электроды, у которых главным недостатком является то, что они разрушаются в процессе электролиза, особенно в растворах хлоридов с невысокой концентрацией. Срок службы графитовых анодов в установках получения гипохлорита составляет не более 3–4 месяцев.
Поэтому графитовые аноды стали заменяться на титановые с активным покрытием из диоксидов рутения и титана, у которых срок службы более 12 месяцев. За рубежом такие аноды имеют аббревиатуру DSA (от англ., Dimensionally Stable Anodes, размерно стабильные аноды), в отечественной практике они более известны под торговой маркой «оксидные рутениево-титановые аноды» (ОРТА). Аноды типа ОРТА и их модификации в процессе эксплуатации не меняют своей формы и в первую очередь межэлектродного расстояния по отношению к противоэлектроду (катоду), чем «грешит» графит, отчасти из-за своей нестойкости. Титановую подложку анодов по мере срабатывания активного покрытия можно подвергать многократной регенерации и повторному нанесению активного покрытия. Это в условиях дефицитности и относительной дороговизны титана является немаловажным положительным фактором.
ОРТА (см. рис.) по сравнению с графитовыми обладают более высокими селективными и электрокаталитическими свойствами по отношению к основному процессу – выделению хлора на аноде, что дает возможность проводить электролиз до более глубокой степени конверсии поваренной соли и снижают ее удельный расход. Все это позволяет при всех прочих равных условиях ведения электролиза осуществлять процесс при более низком значении напряжения в реакторе и интенсифицировать его, используя более высокие анодные плотности тока. Если при использовании графитовых анодов электролиз можно провести при плотностях тока до 1,4 кА/м2, то при электролизе с ОРТА: 1,5 – 2 кА/м2 (для сравнения на платино-титановых анодах можно достичь плотности тока 4 кА/м2).Тем самым увеличивается выход конечного продукта с единицы поверхности анода и обеспечивается возможность выполнять конструкции электролизеров меньших габаритов при аналогичной производительности.

Основным недостатком ОРТА является их сравнительно высокая стоимость. Помимо этого ОРТА нельзя рекомендовать для использования в установках с периодическим изменением полярности электродов, поскольку в результате восстановления окислов на их поверхности образуется металлический рутений, который не стоек в условиях анодной поляризации.
- температура раствора электролита
Процесс окисления гипохлорита с последующим образованием хлоратов замедляется при понижении температуры раствора, поэтому электролиз целесообразно вести при низких температурах в интервале 20 – 25°С.
4. Влияние межэлектродного расстояния на процесс получения ГПХН
Теоритически, чем меньше величина межэлектродных зазоров, тем более эффективен энергетически процесс электролиза хлорида натрия.
Однако минимальная величина межэлектродных зазоров ограничена условием обеспечения протекания через них раствора хлорида натрия, а также технологическими возможностями выполнения плоских поверхностей пластинчатых электродов. Кроме того выяснено, что межэлектродное расстояние δ существенно не влияет на изменение величины h и другие параметры работы электролизера. Изменение величины δ при сохранении площади рабочей поверхности электродов сказывается только на производительности установки. При увеличении межэлектродного расстояния происходит пропорциональное снижение плотности тока i и соответственно снижение общего выхода гипохлорита натрия.
Экспериментально было обнаружено, что в интервале величин межэлектродных зазоров от 1 до 3 мм обеспечивается протекание раствора хлорида натрия между пластинчатыми электродами с минимально возможным гидравлическим сопротивлением. Кроме того, указанный межэлектродный зазор обеспечивает технологическую безопасность соприкосновения поверхностей электродов при изготовлении кассеты.
При использовании в электролизере не одной, а нескольких кассет необходимо учитывать, то, что наличие значительно между электродными кассетами каналов, объединяющими пластинчатые электроды, более широких, чем межэлектродные зазоры, а также канала вдоль дна емкости, обеспечивают равномерную подачу раствора хлорида натрия ко всем электродным кассетам с пластинчатыми электродами. Кроме того такие конструктивные особенности позволяют в ламинарном режиме пропускать через электролизер с меньшим гидравлическим сопротивлением больший поток раствора хлорида натрия, требуемый для получения заданного количества ГХН.
На практике применяются разнообразные конструкции реакторов бездиафрагменных электролизных установок. Их можно разделить на две основные группы: монополярные и биполярные (см. рисунок).
Простота и надежность работы электролизных установок, а также заинтересованность потребителей в применении безопасного электрохимического метода обеззараживания воды привели к созданию огромного числа самых разнообразных по конструкции электролизеров. Они отличаются как принципом включения электродов (биполярные и монополярные), так и конструкцией электродов (коаксиальные, плоскопараллельные) и по другим конструктивным признакам. При создании электролизных установок большой единичной мощности предпочтение отдается плоскопараллельному размещению электродов. В таких электролизерах электролит проходит по синусоидальному пути через ряд биполярных ячеек. Электроды могут быть расположены вертикально или под небольшим углом к вертикали. Применяются также конструкции с горизонтальными электродами. В рамках данной публикации мы рассмотрим наиболее простые из них.
По организации движения электролита в электролизной ванне бездиафрагменные электролизные установки получения гипохлорита натрия подразделяют на проточные и непроточные.
5. Непроточные установки получения ГПХН
Эти установки нашли наиболее широкое распространение. Как правило, конструктивно они представляют собой ванну с установленным там пакетом (или кассетой) электродов. Электроды монополярно или биполярно подключаются к источнику постоянного тока.
Электролизная ванна заполняется раствором поваренной соли, после чего электродная кассета (или кассеты) устанавливается на ванну и на нее подается напряжение. Известно, что при прохождении электрического тока через раствор хлорида натрия происходит образование гипохлорита натрия и выделение водорода, который в виде пузырьков поднимается вверх, увлекая за собой раствор хлорида натрия. Подъемная сила этих пузырьков увеличивает скорость течения раствора хлорида натрия в межэлектродных зазорах, тем самым затягивая его из около донного потока в межэлектродные зазоры между пластинчатыми электродами, которые значительно меньше расстояний между электродными кассетами. При этом в потоке над пластинчатыми электродами будет собираться продукт электролиза – гипохлорит натрия. Процесс электролиза ведут до получения требуемой концентрации активного хлора, после чего готовый раствор сливают в бак-накопитель и весь цикл повторяется сначала.
При работе электролизера необходимо свести к минимуму распад образованного NaClO. Для этого следует процесс электролиза проводить при низкой температуре и большой плотности тока на аноде, воздержаться от перемешивания электролита в ванне.
Примерами таких установок служат установки получения ГПХН серии «Санер», выпускаемые серийно.
ПОСЛЕДНИЕ НОВОСТИ:
08.02.2018 Компания «Мировые Водные Технологии» создала новый раздел Реагентная обработка воды, процессы которой осуществляют путем внесения того или иного химического вещества (реагента) в обрабатываемую воду с целью изменения того или иного показателя качества воды до требуемой величины.08.02.2018 Компания «Мировые Водные Технологии» создала новый раздел Реагентная обработка воды, процессы которой осуществляют путем внесения того или иного химического вещества (реагента) в обрабатываемую воду с целью изменения того или иного показателя качества воды до требуемой величины.
посмотреть все новости
ФОТОГАЛЕРЕЯ РАБОТ:
 Станция очистки воды для водозабрного узла жилого микрорайона "Новый Зеленоград" (первая очередь).
Станция очистки воды для водозабрного узла жилого микрорайона "Новый Зеленоград" (первая очередь).
 Установка деионизованной воды марки «А» для ООО РМТ город Москва
Установка деионизованной воды марки «А» для ООО РМТ город Москва Оборудования для производства деионизованной воды (10 МОм) для питания котла высокого давления для ООО «Агроснабсахар» город Елец.
Оборудования для производства деионизованной воды (10 МОм) для питания котла высокого давления для ООО «Агроснабсахар» город Елец.
посмотреть всю фотогалерею
Мировые Водные Технологии
Тел.: +7(495)944-57-11, +7(495)944-71-90, +7(495)944-66-89Электронная почта: mvt.info@mail.ru
Cайт: wwtec.ru
Время работы: пн-пт 09:00 - 18:00
Адрес: 124460, г.Москва, г.Зеленоград, Восточная промзона, проезд 4807, д.2, стр.4
Почтовый адрес: 1224460, г.Москва, г.Зеленоград, а/я 138